O tym, jak post pozwolił odwrócić rozwój raka w III stadium zaawansowania
Wszystkie artykuły z tej serii:
- O tym, jak post pozwolił odwrócić rozwój raka w III stadium zaawansowania
- Post i spontaniczna regresja nowotworu
Po diagnozie raka priorytetem jest kontrola rozprzestrzeniania się i nawrotów choroby [1]. Jest to oczywiście zrozumiałe, ale pacjenci chcieliby wiedzieć, jakie jeszcze dodatkowe kroki mogą podjąć, by wesprzeć swój organizm w walce z nowotworem [1]. Artykułów o diecie w profilaktyce i leczeniu raka na naszej stronie mamy całe mnóstwo. A co jeśli by tak nie jeść nic? Post żywieniowy ma rzekomo „poprawiać” stan pacjentów nowotworowych [2], tyle że na poparcie tego rodzaju twierdzeń przywołuje się publikacje takie jak badanie z 2013 r. [3], przeprowadzone na wykastrowanych myszach. Wszystko dlatego, że, nad skutecznością postu w leczeniu raka, badań na ludziach po prostu nie ma. Mamy za to kilka opisów przypadków. Przykładowo: „Post wodny i dieta oparta wyłącznie na produktach roślinnych w leczeniu chłoniaka grudkowego w stadium IIIa, o niskim stopniu złośliwości” [4].
Podstawową metodą leczenia chłoniaka grudkowego jest tradycyjna chemioterapia [5]. Niestety u większości pacjentów po kilku latach następuje nawrót raka, a ze względu na swoją toksyczność stosowane leki wywołują poważne skutki uboczne [5]. Prowadzić mogą m.in. do rozwoju nowotworów wtórnych, czyli nowych nowotworów, spowodowanych przez leczenie chemioterapią nowotworu pierwotnego [5]. Nasuwa się więc pytanie – czy nie nadszedł już czas na oficjalne wycofanie tej metody [5]?
A wracając do naszego opisu przypadku: 42-letnia kobieta zgłosiła się do swojego lekarza pierwszego kontaktu z wyczuwalną masą w pachwinie i została natychmiast skierowana na tomografię komputerową [4]. Biopsja chirurgiczna potwierdziła diagnozę: chłoniak grudkowy o niskim stopniu złośliwości [4]. Potem wykryto, że nowotwór zajął węzły chłonne pod pachą, co wskazywało na stadium III ‒ zaawansowany, rozprzestrzeniony po całym organizmie [4]. Rak nie wydawał się agresywny, więc pacjentce zalecono tylko co 3-miesięczną kontrolę, w celu monitorowania progresji choroby [4]. Kobieta nie chciała jednak bezczynnie czekać. Skontaktowała się więc z TrueNorth Health Center w Kaliforni, gdzie, pod nadzorem lekarskim, spróbowała postu wodnego [4].
Pacjentka nigdy wcześniej nie paliła tytoniu, ale odżywiała się w stylu standardowej diety amerykańskiej [4]. Kurację rozpoczęto więc od diety roślinnej opartej na produktach nieprzetworzonych, bez dodatku soli, oleju i cukru [4]. Następnie kobieta przeszła 21-dniowy post wodny, po czym wróciła do diety złożonej z produktów roślinnych o minimalnym stopniu przetworzenia. W diecie znalazły się świeże i surowe owoce oraz warzywa, warzywa gotowane na parze, warzywa pieczone, zboża pełnoziarniste, strączki oraz orzechy i nasiona w ilości około 30 gramów dziennie [4]. Jakie były efekty?
Badanie lekarskie oraz dalsze obserwacje potwierdziły zmniejszenie się zajętych przez raka węzłów chłonnych [4]. Tomografia komputerowa wykazała, że powiększone węzły chłonne skurczyły się nawet o 90% i nie były już aktywne [4]. Efekty widzimy na poniższych zdjęciach.
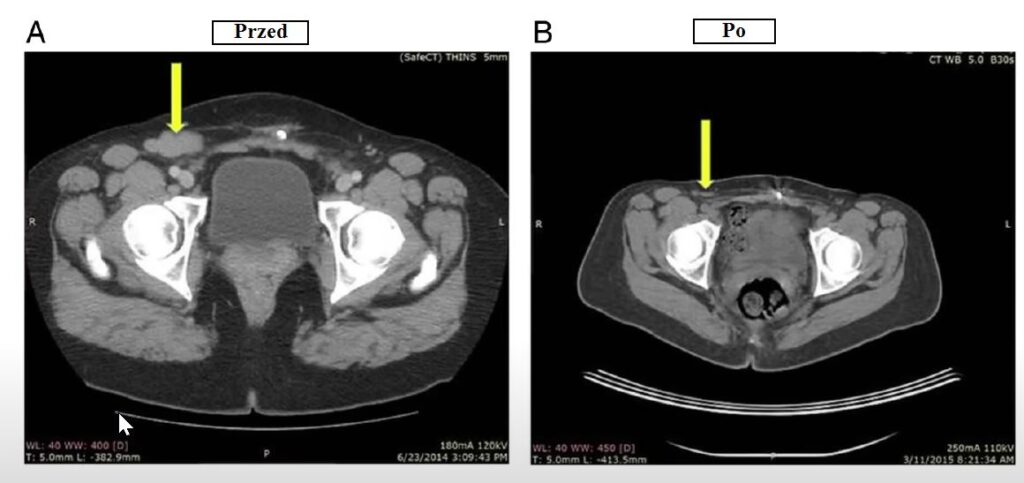 Skąd taka poprawa? Może to kwestia utraty wagi? Kobieta schudła w końcu około 10 kg [4]. Tak, ale nic nie wskazuje na to, by istniała jakaś zależność między rozwojem chłoniaka grudkowego i otyłością [6], a BMI nie wydaje się wpływać na rokowania kliniczne [7]. Możliwe natomiast, że do pewnego stopnia była to zasługa samej diety roślinnej [8]. Chłoniak grudkowy jest drugim z najczęściej diagnozowanych chłoniaków nieziarniczych [5], które to z kolei stanowią najpowszechniejszy rodzaj nowotworów krwi u osób dorosłych [9]. Ryzyko rozwoju chłoniaków nieziarniczych ogranicza wysokie spożycie błonnika, zbóż pełnoziarnistych oraz wielu różnych owoców i warzyw [9]. Z drugiej strony obecne w mięsie i nabiale białko oraz tłuszcze odzwierzęce mogą to ryzyko zwiększać [9].
Skąd taka poprawa? Może to kwestia utraty wagi? Kobieta schudła w końcu około 10 kg [4]. Tak, ale nic nie wskazuje na to, by istniała jakaś zależność między rozwojem chłoniaka grudkowego i otyłością [6], a BMI nie wydaje się wpływać na rokowania kliniczne [7]. Możliwe natomiast, że do pewnego stopnia była to zasługa samej diety roślinnej [8]. Chłoniak grudkowy jest drugim z najczęściej diagnozowanych chłoniaków nieziarniczych [5], które to z kolei stanowią najpowszechniejszy rodzaj nowotworów krwi u osób dorosłych [9]. Ryzyko rozwoju chłoniaków nieziarniczych ogranicza wysokie spożycie błonnika, zbóż pełnoziarnistych oraz wielu różnych owoców i warzyw [9]. Z drugiej strony obecne w mięsie i nabiale białko oraz tłuszcze odzwierzęce mogą to ryzyko zwiększać [9].
W badaniu z 2014 r. [10] dietę o wysokiej podaży mięsa, tłuszczu i słodyczy powiązano z trzykrotnie wyższym ryzykiem rozwoju chłoniaka grudkowego, a w badaniu z 2009 r. [11] wykazano, że samo wysokie spożycie mięsa i tłuszczu zwiększa ryzyko aż pięciokrotnie. Dlaczego? Obserwacja wyższej zapadalności na nowotwory krwi u osób zawodowo narażonych na kontakt ze zwierzętami hodowlanymi i mięsem (np. hodowcy bydła i drobiu, pracownicy sklepów mięsnych, rzeźni) skłoniła badaczy do postawienia hipotezy o potencjalnym związku między produktami pochodzenia zwierzęcego a wzrostem ryzyka zachorowania na te nowotwory [9]. Produkty odzwierzęce stanowią potencjalne źródło zakażenia wirusami wywołującymi raka [12] ‒ takie są fakty i trzeba zdać sobie z nich sprawę. Niewykluczone jednak, że dobroczynny wpływ diety roślinnej sprowadza się tutaj wyłącznie do wykluczenia spożycia białka odzwierzęcego [12].
Nadmierne spożycie białka odzwierzęcego może sprzyjać wystąpieniu zmian nowotworowych [12]. Mechanizm polega tutaj na przewlekłej i nieustannej stymulacji. Podejrzewa się, że ciągła ekspozycja na te obce białka może działać jak czynnik drażniący [12]. Na poparcie tej teorii mamy też fakt, że kazeina, czyli białko mleka, samo w sobie zwiększa liczbę chłoniaków u szczurów [12]. Tylko że szczury to nie ludzie.
A może to wina zawartych w mięsie hormonów [11]? Pewną rolę odgrywają tu pewnie też tłuszcze nasycone. Przecież nie dość, że mogą one osłabiać układ odpornościowy, to jeszcze sprzyjają rozwojowi przewlekłego stanu zapalnego [11], który to z kolei może przyczyniać się do rozwoju chłoniaka [9]. Co istotne, zależność ta dotyczy wyłącznie tłuszczów odzwierzęcych. Tłuszcze roślinne już takiego szkodliwego działania nie wykazują [13]. Może to kwestia czegoś, co się odkłada w zwierzęcej tkance tłuszczowej?
Możliwe, że rozwój chłoniaków nieziarniczych wiąże się z ekspozycją na zanieczyszczenia przemysłowe [14]. Warto podkreślić, że dla ogółu populacji bezpośrednim źródłem niemal wszystkich dioksyn i PCB jest jedzenie, a w szczególności mięso, mleko i ryby [15]. Związki podobne do dioksyn odkładają się w tkance tłuszczowej zwierząt i drogą pokarmową mogą przedostawać się do organizmu człowieka [16]. W przypadku wegetarian stopień narażenia na dioksyny wynosi ok. 2% tego, z czym musi się zmagać ogół populacji [17].
W USA rekord w stężeniu tych szkodliwych związków odnotowano dla kurczaka [18]. Na szczęście stopień zanieczyszczenia mięsa ogółem wykazuje obecnie tendencję spadkową [18]. Co więcej, konsumenci mogą sami ograniczyć ekspozycję na toksyczne substancje obecne w produktach odzwierzęcych [18]. Przede wszystkim mięso należy okrajać z tłuszczu, zarówno przed obróbką termiczną, jak i po jej zakończeniu, oraz dokładnie odcedzać tłuszcz, który się z mięsa wygotowuje [18].
A co z mięsem ekologicznym? Odpowiedzi na to pytanie dostarcza nam badanie z 2017 r. [19] i praktycznie wszystko wiadomo już po samym tytule: „Spożycie mięsa ekologicznego nie zmniejsza potencjału rakotwórczego, związanego ze spożyciem trwałych zanieczyszczeń organicznych”. Jeśli chodzi o stężenie rakotwórczych substancji zanieczyszczających, różnica między mięsem ekologicznym i konwencjonalnym była zaskakująco niska [19]. W obu przypadkach poziom zanieczyszczenia przebadanych próbek przekraczał limity maksymalne [19]. Co jeszcze bardziej szokujące, nie dość, że spożycie mięsa ekologicznego ekspozycji na związki rakotwórcze nie zmniejsza, to jeszcze, niejednokrotnie, wręcz ją zwiększa [19].
Tym, co rzeczywiście zmniejsza ekspozycję na pestycydy rozpuszczalne w tłuszczach, jest spożycie błonnika [20]. Wchłanianie tych szkodliwych związków zachodzi w jelitach, a błonnik może ten proces częściowo hamować [20]. Co więcej, w ponad stu opublikowanych badaniach udowodniono, że dobre bakterie jelitowe wytwarzają z błonnika maślan sodu, który z jelita grubego trafia do całego organizmu i hamuje rozwój nowotworów [21], w tym chłoniaków [22]. Jakby tego było mało, maślan sodu wykazuje też silne właściwości przeciwzapalne [22]. Być może właśnie dlatego spożycie owoców i warzyw wiąże się nie tylko z obniżeniem ryzyka rozwoju chłoniaka, ale również ze zwiększeniem szans na przeżycie [23]. Niewykluczone, że w przypadku chłoniaka grudkowego ochronne działanie roślin jest wynikiem wysokiej zawartości przeciwutleniaczy [24]. Należy jednak zaznaczyć, że chodzi tu o przeciwutleniacze pochodzące z żywności, nie z suplementów diety [24]. Przykładowo witamina C działa profilaktycznie, gdy pochodzi z jedzenia, lecz w postaci suplementów, już nie wykazuje takiego działania [24].
Zatem może powody, dla których weganie i wegetarianie mają niższe ryzyko rozwoju chłoniaków i nowotworów szpiku kostnego nie sprowadzają się wyłącznie do tego, co diety bezmięsne wykluczają [25]. Możliwe, że pewne znaczenie mają też produkty roślinne, które stanowią bazę diety wegańskiej i wegetariańskiej [26]. Unikanie mięsa wraz z jego potencjalnie rakotwórczymi właściwościami to nie wszystko [26]. Fitoskładniki i przeciwutleniacze z owoców i warzyw mogą hamować progresję nowotworów, a mechanizmów podłoża tych działań jest wiele [26]. Biorąc pod uwagę fakt, że spożycie owoców i warzyw wiąże się z wyższą przeżywalnością osób cierpiących na chłoniaka, dobrze by było, gdyby diagnoza tego rodzaju nowotworu mogła stanowić dla pacjentów swego rodzaju „nauczkę” i bodziec do wprowadzenia w swojej diecie odpowiednich zmian [27]. Bohaterka omówionego w tym artykule opisu przypadku jest najlepszym dowodem na to, że warto [4]. Po upływie 6 i 9 miesięcy pacjentka zgłosiła się na wizyty kontrolne [4]. W dalszym ciągu trzymała się diety w 100% roślinnej, opartej na produktach nieprzetworzonych, a po jej powiększonych węzłach chłonnych nadal nie było śladu [4]. No dobrze, ale przecież mowa tu o publikacji z 2015 r. Jak ta pacjentka miewa się obecnie [28]? Przekonamy się w następnym artykule.
Źródło: nutritionfacts.org
[1] Frenkel M, Sierpina V, Sapire K. Effects of complementary and integrative medicine on cancer survivorship. Curr Oncol Rep. 2015;17(5):445.[2] Nair PMK, Khawale PG. Role of therapeutic fasting in women’s health: an overview. J Midlife Health. 2016;7(2):61-64.
[3] Caso J, Masko EM, Ii JAT, et al. The effect of carbohydrate restriction on prostate cancer tumor growth in a castrate mouse xenograft model. Prostate. 2013;73(5):449-454.
[4] Goldhamer AC, Klaper M, Foorohar A, Myers TR. Water-only fasting and an exclusively plant foods diet in the management of stage IIIa, low-grade follicular lymphoma. BMJ Case Rep. 2015;2015:bcr2015211582.
[5] Fowler N. Frontline strategy for follicular lymphoma: are we ready to abandon chemotherapy? Hematology Am Soc Hematol Educ Program. 2016;2016(1):277-283.
[6] Larsson SC, Wolk A. Obesity and risk of non-Hodgkin’s lymphoma: a meta-analysis. Int J Cancer. 2007;121(7):1564-1570.
[7] Hong F, Habermann TM, Gordon LI, et al. The role of body mass index in survival outcome for lymphoma patients: US intergroup experience. Ann Oncol. 2014;25(3):669-674.
[8] Solimini AG, Lombardi AM, Palazzo C, De Giusti M. Meat intake and non-Hodgkin lymphoma: a meta-analysis of observational studies. Cancer Causes Control. 2016;27(5):595-606.
[9] Caini S, Masala G, Gnagnarella P, et al. Food of animal origin and risk of non-Hodgkin lymphoma and multiple myeloma: A review of the literature and meta-analysis. Crit Rev Oncol Hematol. 2016;100:16-24.
[10] Ollberding NJ, Aschebrook-Kilfoy B, Caces DBD, Smith SM, Weisenburger DD, Chiu BCH. Dietary patterns and the risk of non-Hodgkin lymphoma. Public Health Nutr. 2014;17(7):1531-1537.
[11] Erber E, Maskarinec G, Gill JK, Park SY, Kolonel LN. Dietary patterns and the risk of non-Hodgkin lymphoma: the Multiethnic Cohort. Leuk Lymphoma. 2009;50(8):1269-1275.
[12] Cunningham AS. Lymphomas and animal-protein consumption. Lancet. 1976;2(7996):1184-1186.
[13] Han TJ, Li JS, Luan XT, Wang L, Xu HZ. Dietary fat consumption and non-Hodgkin’s lymphoma risk: a meta-analysis. Nutr Cancer. 2017;69(2):221-228.
[14] Czarnota J, Gennings C, Colt JS, et al. Analysis of environmental chemical mixtures and non-Hodgkin lymphoma risk in the NCI-SEER NHL Study. Environ Health Perspect. 2015;123(10):965-970.
[15] Fernández-González R, Yebra-Pimentel I, Martínez-Carballo E, Simal-Gándara J. A critical review about human exposure to polychlorinated dibenzo-p-dioxins (PCDDs), polychlorinated dibenzofurans (PCDFs) and polychlorinated biphenyls (PCBs) through foods. Crit Rev Food Sci Nutr. 2015;55(11):1590-1617.
[16] Institute of Medicine (US) Committee on the Implications of Dioxin in the Food Supply. Dioxins and Dioxin-like Compounds in the Food Supply: Strategies to Decrease Exposure. National Academies Press (US); 2003.
[17] Schecter A, Startin J, Wright C, et al. Congener-specific levels of dioxins and dibenzofurans in U.S. food and estimated daily dioxin toxic equivalent intake. Environ Health Perspect. 1994;102(11):962-966.
[18] Lupton SJ, O’Keefe M, Muñiz-Ortiz JG, Clinch N, Basu P. Survey of polychlorinated dibenzo-p-dioxins, polychlorinated dibenzofurans and non-ortho-polychlorinated biphenyls in US meat and poultry, 2012-13: toxic equivalency levels, patterns, temporal trends and implications. Food Addit Contam Part A Chem Anal Control Expo Risk Assess. 2017;34(11):1970-1981.
[19] Hernández ÁR, Boada LD, Mendoza Z, et al. Consumption of organic meat does not diminish the carcinogenic potential associated with the intake of persistent organic pollutants (POPs). Environ Sci Pollut Res Int. 2017;24(5):4261-4273.
[20] Ta CA, Zee JA, Desrosiers T, et al. Binding capacity of various fibre to pesticide residues under simulated gastrointestinal conditions. Food Chem Toxicol. 1999;37(12):1147-1151.
[21] Bultman SJ. Molecular pathways: gene-environment interactions regulating dietary fiber induction of proliferation and apoptosis via butyrate for cancer prevention. Clin Cancer Res. 2014;20(4):799-803.
[22] Wei W, Sun W, Yu S, Yang Y, Ai L. Butyrate production from high-fiber diet protects against lymphoma tumor. Leuk Lymphoma. 2016;57(10):2401-2408.
[23] Charbonneau B. Dangling the carrot of improved survival in non-Hodgkin lymphoma: does carotenoid consumption make a difference? Leuk Lymphoma. 2013;54(12):2577-2578.
[24] Thompson CA, Habermann TM, Wang AH, et al. Antioxidant intake from fruits, vegetables and other sources and risk of non-Hodgkin’s lymphoma: the Iowa Women’s Health Study. Int J Cancer. 2010;126(4):992-1003.
[25] Key TJ, Appleby PN, Crowe FL, Bradbury KE, Schmidt JA, Travis RC. Cancer in British vegetarians: updated analyses of 4998 incident cancers in a cohort of 32,491 meat eaters, 8612 fish eaters, 18,298 vegetarians, and 2246 vegans. Am J Clin Nutr. 2014;100 Suppl 1:378S-85S.
[26] Leo QJN, Ollberding NJ, Wilkens LR, et al. Nutritional factors and non-Hodgkin lymphoma survival in an ethnically diverse population: the Multiethnic Cohort. Eur J Clin Nutr. 2016;70(1):41-46.
[27] Thompson CA, Cerhan JR. Fruit and vegetable intake and survival from non-Hodgkin lymphoma: does an apple a day keep the doctor away? Leuk Lymphoma. 2010;51(6):963-964.
[28] Myers TR, Zittel M, Goldhamer AC. Follow-up of water-only fasting and an exclusively plant food diet in the management of stage IIIa, low-grade follicular lymphoma. BMJ Case Rep. 2018;2018:bcr2018225520.

