Co jest przyczyną przerzutów nowotworowych?
Jest to pierwszy z serii trzech artykułów poświęconych przerzutom nowotworowym. Przyjrzymy się w nich składnikom pokarmowym, które przyczyniają się do rozprzestrzeniania raka, jak również interwencjom żywieniowym, a nawet konkretnym produktom, które ograniczyć mogą ryzyko wystąpienia przerzutów i, tym samym, zwiększyć szanse przeżycia. Zapraszamy do lektury.
Rozwój przerzutów jest główną przyczyną śmierci pacjentów nowotworowych [1]. W większości przypadków ludzie umierają na raka właśnie w wyniku wystąpienia przerzutów; nie guza pierwotnego, tylko rozprzestrzeniania się nowotworu w organizmie [1]. „Szacuje się, że przerzuty odpowiedzialne są za 90% zgonów nowotworowych” [2]. Jak na razie, mimo całego nowoczesnego wyposażenia medycznego, nasze postępy w powstrzymywaniu przerzutów są wciąż bardzo niewielkie [2]. Niejednokrotnie leczenie wyrządzić może więcej szkody niż pożytku; leczenie nowotworów może być przyczyną przerzutów [3]. Wszystkie powszechnie stosowane metody leczenia raka, a więc naświetlania, chemioterapia i operacje, czy nawet nakłuwanie guzów w ramach biopsji, mogą potencjalnie przyczynić się do pogłębienia problemu [3]. Nietrudno sobie wyobrazić, że wycinanie kawałka guza, przecinanie naczyń krwionośnych, skończyć się może migracją pozostałych komórek nowotworowych [3]. Ale chemioterapia? Jak do powstania przerzutów może przyczyniać się chemioterapia [4]? Oprócz zmniejszania rozmiaru guzów pierwotnych chemioterapia może zmieniać otaczające tkanki, co prowadzić może do nasilenia przenikania komórek nowotworowych do krwiobiegu [4]. Stosowanie chemioterapii, operacji i naświetlań w wielu przypadkach jest całkowicie uzasadnione, jednak czasem te metody leczenia mogą przyczyniać się do pogorszenia sytuacji. Gdyby tylko istniał jakiś sposób leczenia samej przyczyny rozprzestrzeniania się nowotworów [2].
Przez długi czas czynnikiem uniemożliwiającym opracowanie terapii przeciwprzerzutowych były trudności w zidentyfikowaniu komórek, które zapoczątkowują rozwój przerzutów [5]. Przełomem było badanie z 2017 r. [5] Naukowcy odkryli subpopulację komórek nowotworowych o „wyjątkowej zdolności do inicjowania przerzutów” [5]. Stwierdzono dla nich zwiększoną ekspresję receptora tłuszczu CD36 [5], nazywanego „kontrolerem tłuszczu” [6]. Jak się okazuje, do wzrostu potencjału metastatycznego tych komórek przyczynia się przede wszystkim kwas palmitynowy i, ogólnie, dieta wysokotłuszczowa [5]. W jakich produktach występuje kwas palmitynowy? Chociaż pierwotnie odkryty został jako składnik oleju palmowego, najbardziej skoncentrowane źródła tego kwasu to mięso i nabiał [7]. „Coraz więcej danych wskazuje na rolę kwasu palmitynowego jako cząsteczki sygnalizacyjnej, regulującej rozwój i postępowanie wielu chorób na poziomie cząsteczkowym” [8]. To właśnie ten rodzaj tłuszczu nasyconego jest rozpoznawany przez receptor CD36 na powierzchni komórek nowotworowych [5]. Wiemy, że do wystąpienia przerzutów dochodzi z winy właśnie tego receptora, ponieważ jego zablokowanie hamuje rozprzestrzenianie się raka [5].
Powyższe dane dotyczą nowotworów człowieka [5]. Co prawda w badaniu ludzkie komórki nowotworowe wszczepione zostały myszom, jednak wyniki znajdują potwierdzenie również w warunkach klinicznych (czyli u pacjentów nowotworowych). Obecność wspomnianych już, pokrytych receptorami CD36, komórek nowotworowych, które zdolne są do inicjowania przerzutów, związana jest ze złymi rokowaniami [5]. Receptor CD36 napędza, na przykład, wzrost nowotworów mózgu [9]. Krzywe przeżycia [9] pokazują, że znacznie dłużej żyją osoby z guzami o niższej ekspresji receptora CD36.
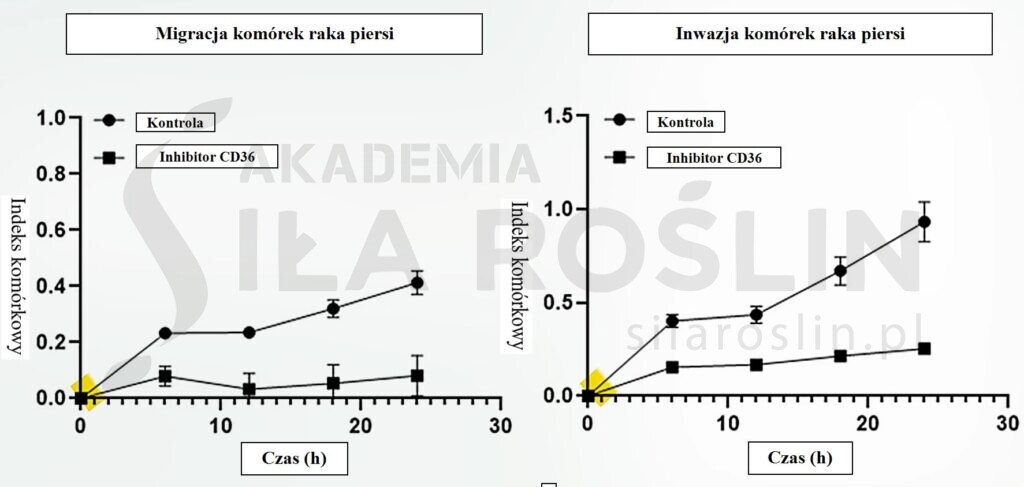
To samo w przypadku śmiertelności raka piersi [10]. I nic dziwnego, w końcu „CD36 wydaje się odgrywać kluczową rolę w proliferacji, migracji i we wzroście komórek raka piersi” [10]. Zablokowanie CD36 pozwala na „zahamowanie migracji i inwazji komórek raka piersi” [11]. Poniższe wykresy [11] przedstawiają migrację i inwazję komórek raka piersi przed i po zastosowaniu inhibitora receptora CD36.
Co więcej działanie CD36 nie ogranicza się tylko do „czerniaka i raka piersi” [5]. Obecnie podejrzewa się, że „CD36 napędza również wzrost i rozwój przerzutów raka jajnika” [12]. Zablokowanie CD36 pozwala bowiem na powstrzymanie inwazji i migracji komórek raka jajnika, jak również zahamowanie przerzutów, zarówno drogą naczyń krwionośnych, jak i węzłów chłonnych [12]. Takie same wyniki osiągnięto w przypadku raka prostaty [13]. Powstrzymując wchłanianie tłuszczu przez komórki raka prostaty, powstrzymać można rozwój nowotworu [13]. Przytoczone badania przeprowadzone zostały w warunkach laboratoryjnych; receptor CD36 blokowano przy zastosowaniu odpowiednich leków i przeciwciał [13]. A przecież skoro inicjujące przerzuty komórki nowotworowe w rozprzestrzenianiu nowotworu polegają w dużej mierze na tłuszczach pokarmowych [5], dlaczego nie zablokować im po prostu dostępu do tłuszczu?
Komórki nowotworowe tłuszcz i cholesterol wprost uwielbiają [14]. Powodem, dla którego metabolizm tłuszczów może wspomagać rozprzestrzenianie się nowotworów są zawarte w tłuszczu duże ilości energii [5]. „Korzystają na tym komórki odpowiedzialne za rozwój przerzutów. Tłuszcz jest dla nich dobrym źródłem energii, której potrzebują prawdopodobnie, by zakotwiczyć się i przetrwać w miejscach oddalonych od guza pierwotnego” [5].
„Czasy, kiedy cukier uważany był za główny, jeśli nie jedyny, czynnik napędzający proliferację komórek nowotworowych to już przeszłość” [15]. Wygląda na to, że „przerzuty nowotworowe to wina tłuszczu” [16]. Nic dziwnego, że „dieta wysokotłuszczowa odgrywa kluczową rolę w zwiększaniu ryzyka rozwoju różnych rodzajów nowotworów, w tym nowotworów zaawansowanych” [16]. No dobrze, skoro tłuszcz „oliwi trybiki nowotworowej maszynerii” [17], czy istnieje jakiś sposób odżywiania, który pozbawiłby raka dopływu tłuszczu [17]? Odpowiedzi szukać będziemy w badaniach naukowych [18], w kolejnym artykule z tej serii.
Źródło: https://nutritionfacts.org/
[1] Elia I, Doglioni G, Fendt S-M. Metabolic hallmarks of metastasis formation. Trends Cell Biol. 2018;28(8):673-84.[2] Lee W-C, Kopetz S, Wistuba II, Zhang J. Metastasis of cancer: when and how? Ann Oncol. 2017;28(9):2045-7.
[3] Martin OA, Anderson RL. Editorial: Therapy-induced metastasis. Clin Exp Metastasis. 2018;35(4):219-21.
[4] Middleton JD, Stover DG, Hai T. Chemotherapy-exacerbated breast cancer metastasis: A paradox explainable by dysregulated adaptive-response. Int J Mol Sci. 2018;19(11):3333.
[5] Pascual G, Avgustinova A, Mejetta S, et al. Targeting metastasis-initiating cells through the fatty acid receptor CD36. Nature. 2017;541(7635):41-5.
[6] Villanueva MT. Metastasis: The fat controller. Nat Rev Cancer. 2017;17(2):76-7.
[7] Carta G, Murru E, Banni S, Manca C. Palmitic acid: Physiological role, metabolism and nutritional implications. Front Physiol. 2017;8:902.
[8] Fatima S, Hu X, Gong RH, et al. Palmitic acid is an intracellular signaling molecule involved in disease development. Cell Mol Life Sci. 2019;76(13):2547-57.
[9] Hale JS, Otvos B, Sinyuk M, et al. Cancer stem cell-specific scavenger receptor CD36 drives glioblastoma progression. Stem Cells. 2014;32(7):1746-58.
[10] Liang Y, Han H, Liu L, et al. CD36 plays a critical role in proliferation, migration and tamoxifen-inhibited growth of ER-positive breast cancer cells. Oncogenesis. 2018;7:98.
[11] Zaoui M, Morel M, Ferrand N, et al. Breast-associated adipocytes secretome induce fatty acid uptake and invasiveness in breast cancer cells via CD36 independently of body mass index, menopausal status and mammary density. Cancers (Basel). 2019;11(12):2012.
[12] Ladanyi A, Mukherjee A, Kenny HA, et al. Adipocyte-induced CD36 expression drives ovarian cancer progression and metastasis. Oncogene. 2018;37(17):2285-301.
[13] Watt MJ, Clark AK, Selth LA, et al. Suppressing fatty acid uptake has therapeutic effects in preclinical models of prostate cancer. Sci Transl Med. 2019;11(478):eaau5758.
[14] Li Z, Kang Y. Lipid metabolism fuels cancer’s spread. Cell Metab. 2017;25(2):228-30.
[15] Corbet C, Feron O. Emerging roles of lipid metabolism in cancer progression. Curr Opin Clin Nutr Metab Care. 2017;20(4):254-60.
[16] Yeudall WA, Shahoumi L. A fatter way to metastasize. Oral Dis. 2018;24(5):679-81.
[17] Snaebjornsson MT, Janaki-Raman S, Schulze A. Greasing the wheels of the cancer machine: The role of lipid metabolism in cancer. Cell Metab. 2020;31(1):62-76.
[18] Chlebowski RT, Blackburn GL, Thomson CA, et al. Dietary fat reduction and breast cancer outcome: Interim efficacy results from the Women’s Intervention Nutrition Study. J Natl Cancer Inst. 2006;98(24):1767-76.